¿Alguna vez un productor ha ido a decirle que el insecticida que Ud. le vendió o le aplicó para él, no hizo un buen trabajo controlando los insectos?
Usted probablemente le atribuyó la reducción del control tanto a una mala partida del producto como a una pobre aplicación o a una resistencia de la plaga o quizá el productor ni siquiera sabía sobre lo que estaba hablando. Pero, ¿cuántos de ustedes han medido alguna vez el pH del agua antes de mezclar el insecticida?
Si lee atentamente la etiqueta del pesticida, es muy probable que encuentre una advertencia contra la mezcla del mismo con materiales alcalinos, tales como óxido de calcio o polisulfuro de calcio, La razón de esto es que muchos pesticidas, particularmente los órganofosforados y los carbamatos, atraviesan una reacción química en presencia de componentes alcalinos que destruyen su efectividad. Esta reacción es llamada hidrólisis alcalina y ocurre cuando el pesticida es mezclado con agua alcalina (con un pH mayor a 7). A mayor alcalinidad del agua, más rápido se
desvanece la efectividad de los mismos.
Se ha mostrado recientemente, que en algunas áreas de Estados Unidos las fuentes de agua tienen la alcalinidad natural suficiente como para causar la hidrólisis de ciertos pesticidas. Esto significa que un pesticida puede comenzar a colapsar tan pronto como se ha agregado al tanque. En términos prácticos, el grado de control de la plaga puede ser a veces menor que la deseada y aún no existir control, porque una cierta cantidad de ingrediente activo se descompone a una forma inocua antes de que alcance la planta y la plaga. Y si la mezcla en el tanque permanece varias horas o toda la noche antes de ser aplicada, tanto como el 50% ó más de ingrediente activo puede ser descompuesto.
Química de la Hidrólisis Alcalina
Para entender mejor el fenómeno de la hidrólisis alcalina, echemos un vistazo a la química usando los insecticidas órganofosforados como ejemplo. El átomo del fósforo divide el compuesto en dos partes. Los insecticidas órganofosforados son efectivos cuando las dos partes del químico están juntas. Cuando las partes están separadas los órganofosforados son generalmente inocuos.
Como Ud. ya sabe, el agua está hecha de dos partes de hidrógeno (H) y una de oxígeno (O) (H2O).
También encontrará las partículas cargadas o iones en el agua; ambos, H+ y HO-, y dependiendo de donde provenga el agua, puede haber una abundancia tanto de H+ como de iones HO-. A mayor cantidad de H+ en el agua, mayor la acidez; cuanto más HO-, mayor alcalinidad.
Esto puede parecer demasiado elemental, pero siento que es necesario para comprender la química del agua en función de la hidrólisis alcalina. El ión oxidrilo (HO-) reacciona rápidamente con la molécula de fósforo, dividiéndola en dos partes. A mayor alcalinidad del agua (mayor presencia de OH-), más rápida será la pérdida de producto. Esto es lo que sucede a la mayoría de los órganofosforados y carbamatos en presencia de agua alcalina, el grado de destrucción varía de acuerdo a la alcalinidad y la temperatura del agua y el tiempo en que la mezcla permanece en el tanque.
¿Qué pesticidas son afectados por la alcalinidad del agua?
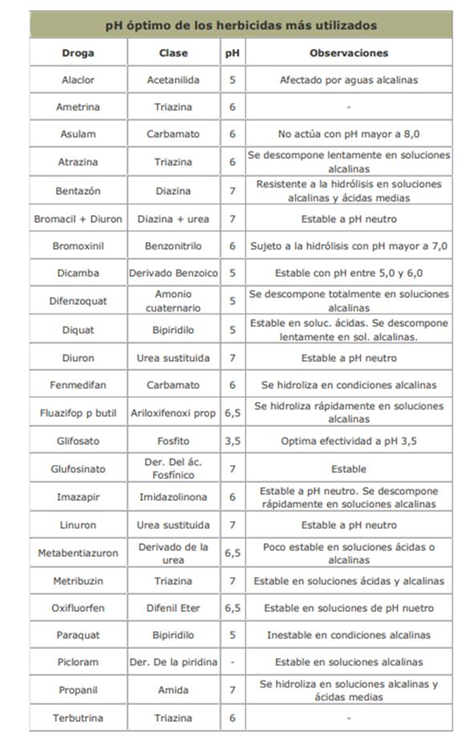
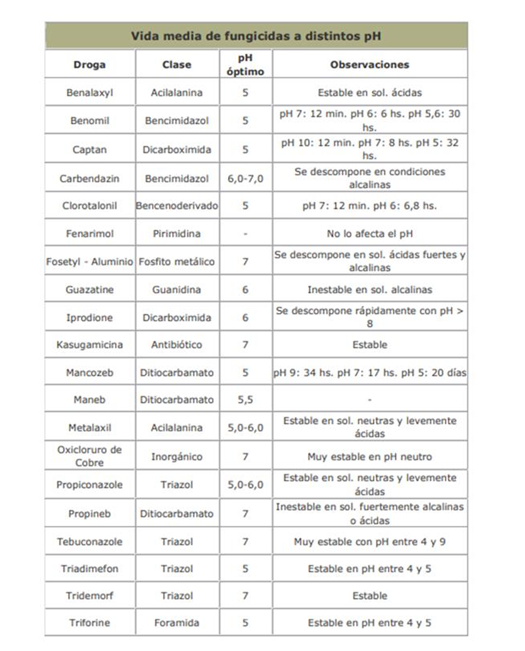
Aunque hay un gran tipo de variaciones, en general encontramos que los insecticidas son afectados más severamente que los herbicidas y fungicidas. Y encontramos además que los órganofosforados y los carbamatos se descomponen mucho más rápido que los clorados.
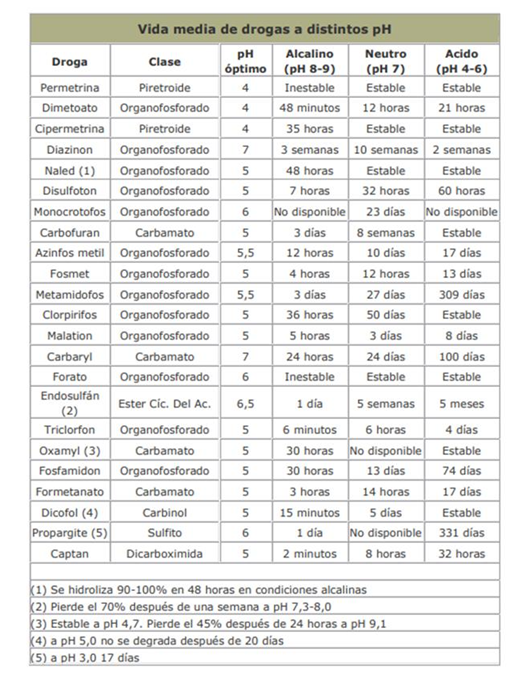
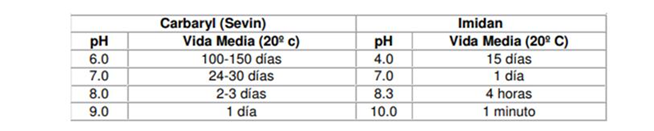
Algunos fabricantes proveen información sobre el nivel a los que sus productos se hidrolizan. Este nivel se expresa generalmente en «vida media» o «el tiempo en que le lleva para que se hidrolice el 50%». Con triclorfon, por ejemplo, el tiempo para que ocurra el 50% de la hidrólisis a pH 8.0 es 63 minutos; a pH 7.0 ocurre en 386 minutos y a pH 6.0, 80 horas. Esto significa que si el pH de su agua es 8.0 y pasa una hora desde que agregó el insecticida al tanque y lo aplicó, el 50% de la materia activa ya está descompuesta. Pero si el agua tiene un pH 6.0, no perderá una cantidad significativa durante la aplicación.
Veamos otros ejemplos:
Baje el pH en su tanque de aplicación
Si su fuente de agua es alcalina, especialmente si el pH es 8 o más, y está usando un pesticida sensible a la hidrólisis, debería bajar el pH del agua. Un pH en un rango de 4-6 es el recomendado para la mayoría de las aplicaciones de pesticidas. Puede llevar el agua a un pH entre 4 y 6 usando alguno de los coadyuvantes que se venden como agentes búffer.
Una pregunta que se realiza siempre es si la acidificación incrementa la acción residual del pesticida en la planta, afectando de tal manera aquellos factores como tiempo de carencia e intervalos de pre-cosecha. Tests sobre residuos en follaje fumigados con paratión acidificado y no acidificado no han mostrado ninguna diferencia sobre el grado de degradación del paratión. Esto debería esperarse ya que el pH del follaje ronda el valor de 7.0
Hay algunos pocos pesticidas que no debería acidificarse bajo ninguna circunstancia. Mezclas conteniendo fungicidas a partir de cobre (incluyendo caldo bordelés, óxido de cobre, sulfato de cobre, hidróxido de cobre, etc.) y óxido de calcio y polisulfuro de calcio no deberían ser acidificados. Pero, si el marbete indica evitar materiales alcalinos, hay muchas posibilidades de que la mezcla se vea beneficiada ajustando el pH a 6 ó menos.
El mayor beneficio sobre la acidificación es obtenido durante el tiempo en que el pesticida está en el tanque; esto es, desde que el pesticida es agregado en el tanque hasta que es aplicado sobre el follaje.
Si su fuente de agua es alcalina, agregando un agente búffer a la mezcla es una manera fácil y económica de garantizar los máximos resultados de sus aplicaciones.
En las tablas siguientes, se presentan la vida media de los agroquimicos mas utilizados, a distintos pH.