INTRODUCCION
En todo cultivo existe una marcada diferencia entre su productividad potencial y la productividad obtenida. Una serie de causas permiten explicar dicha diferencia, las cuales se han agrupado bajo el nombre general de estrés, pudiendo ser este definido como toda situación que afecte las condiciones ideales de crecimiento de la planta debido a la alteración de su fisiología, impidiéndose finalmente la expresión total del rendimiento para el cual está genéticamente capacitada.
Existen fundamentalmente dos tipos de estrés, el abiótico, en el que están incluidos aquellos factores ambientales relacionados con el clima y el suelo (temperatura, humedad del suelo, fertilidad del suelo, etc.), y el biótico que se refiere a todas aquellas entidades biológicas que utilizan los productos metabólicos de la planta para completar su ciclo de vida (insectos plagas, y enfermedades, fundamentalmente).
Dependiendo del cultivo y de sus condiciones de manejo, habrá una mayor o menor importancia de los tipos de estrés que lo afectan, existiendo una amplia gama de información y de líneas de investigación dedicadas al logro de la mayor productividad en presencia de condiciones desfavorables.
En lo referente al estrés biótico, Cramer (1967) estimó que las pérdidas económicas en los cultivos por causa de enfermedades fue de 11,8 % y por causa de insectos plaga de 12,2 %. En años más recientes se ha destacado la imposibilidad de poder sembrar ciertos cultivos en determinadas zonas geográficas por la magnitud y severidad del ataque de insectos plaga y enfermedades (James, 1981; Robinson, 1987).

En el cultivo del ajonjolí existe un cierto cúmulo de información acerca de los insectos plaga y enfermedades que lo afectan, sin embargo, en el caso particular de insectos plaga hay muy poca información actual, lo cual se puede constatar al observar la casi inexistencia de investigaciones de mosca blanca en el cultivo, a pesar de ser esta no sólo el más importante insecto plaga actual del cultivo, sino su mayor limitante de producción (Laurentin, 1996), situación que desde aproximadamente 1990 aún sigue vigente.
Esta problemática ha llevado a la Universidad Centroccidental Lisandro Alvarado a desarrollar una línea de investigación relacionada con la interacción establecida entre mosca blanca y ajonjolí, con la finalidad de generar la información básica necesaria para determinar la conveniencia o no de iniciar un programa de mejoramiento genético de ajonjolí con miras a incorporar la resistencia genética a este insecto plaga como criterio de selección.
El objetivo del presente artículo es dar a conocer el estado actual del conocimiento acerca de la interacción mosca blanca – ajonjolí, de tal manera de suministrar a las personas que hacen vida activa con el cultivo, las herramientas que le permitan un adecuado manejo de la mosca blanca en el ajonjolí.
- DAÑOS CAUSADOS POR LA MOSCA BLANCA
La mosca blanca (Bemisia sp. HOMOPTERA:ALEYRODIDAE) ha sido reportada en numerosos cultivos como una plaga de importancia económica (Arnal, 1991; Simmons, 1994). En Venezuela se ha reportado sobre algodón, pimentón, tomate, papa, melón, tabaco y ajonjolí, ocasionando daño directo por succión de savia, y daños indirectos por transmisión de virus fitopatógenos (Arnal et al., 1993), sin embargo, en ajonjolí no se ha reportado transmisión de virus mediante la mosca blanca, pero sí se ha reportado la magnitud de los daños directos. Delgado (1993) estimó disminuciones en el rendimiento del cultivo que oscilan entre 88 y 100 %, Montilla y Terán (1995) estimaron este parámetro en un 13 %, explicándose en ambos trabajos que el efecto deprimente sobre el rendimiento se debe a la disminución del peso de los granos y al incremento en el número de semillas vanas.

2. MUESTREO DE MOSCA BLANCA
Generalmente se menciona la importancia del muestreo en la toma de decisiones de control para un programa de manejo integrado de plagas (Bynns y Nyrop, 1992; Ekbon y Rumei, 1990; Naranjo y Flynt, 1994; Naranjo et al., 1997), sin embargo hay que destacar la importancia que este también tiene a los fines de identificar germoplasma resistente a un determinado insecto, tal como lo señalan de Ponti et al. (1990). Butler et al. (1988) señalan la necesidad de tener estimados muy confiables de la población insectil cuando se están identificando variedades resistentes. Lynch y Simmons (1993) señalan que el patrón de distribución sobre un hospedero es requisito indispensable para el desarrollo de técnicas de muestreo eficientes para registrar las poblaciones de B. tabaci. La eficiencia en esta identificación dependerá grandemente de la forma como se haga el muestreo entre los distintos genotipos que se están evaluando, lo cual está en función de la distribución espacial del insecto en la planta (Ekbom y Rumei, 1990). En base a lo señalado, se puede afirmar que en toda relación insecto plaga – cultivo, es de importancia capital determinar cómo, cuándo, dónde y qué muestrear para obtener un estimado de la población del insecto en el cultivo, lo cual se hace necesario para alcanzar alguno de los siguientes objetivos:
- Determinar la conveniencia o no de aplicar medidas de control de la población del insecto plaga.
- Determinar la existencia de genes de resistencia, según la población alcanzada en distintos genotipos.
- Estimar las fluctuaciones numéricas que existan en la población del insecto durante el ciclo del cultivo.
2.1. ¿Qué y cómo muestrear?
En ajonjolí, sólo se ha reportado la presencia de la especie Bemisia tabaci. Su ciclo de vida comprende las fases de huevo, ninfa y adulto, ante tal situación, podría existir la disyuntiva acerca de cual de las formas vivas de mosca blanca es más conveniente colectar para poder tener un estimado acerca de la población del insecto en el cultivo. Ekbon y Rumei (1990) señalan la posibilidad de muestrear adultos o estados inmaduros (huevos y ninfas), considerando que el contaje de estos últimos permite una medida más confiable del nivel de población del insecto. Este tipo de mustreo debe realizarse por observación directa del número de ninfas sobre las hojas, pudiendo lograrse en forma similar la estimación del número de huevos. En relación al muestreo de adultos, se hace necesaria la búsqueda de alternativas distintas a la observación directa, debido fundamentalmente a su gran movilidad lo cual prácticamente imposibilita la obtención de estimados confiables de la población del insecto. Entre estas alternativas, las trampas amarillas han arrojado muy buenos resultados.

2.2. ¿Dónde muestrear?
Pereira y Laurentin (1999) evaluaron los hábitos de vuelo de la mosca blanca con la finalidad de conocer la forma más adecuada de obtener muestras de adultos. Para tal fin utilizaron trampas amarillas de dos caras ubicadas a 25, 50, 75, 100, 125 y 150 cm de altura en un cultivo comercial ubicado en las cercanías de El Playón, estado Portuguesa. En dicho estudio se concluyó que los adultos de mosca blanca son arrastrados por el viento y al detectar al cultivo, bajan hacia él consiguiendo alimento y protección, ubicándose más frecuentemente en una altura 25-50 cm donde se colectaron durante seis semanas mas del 50 % del total de adultos. Este trabajo permite señalar que el registro de fluctuaciones de población de mosca blanca mediante el muestreo de adultos con trampas amarillas se debe concentrar entre 25 y 50 cm (figura 1).
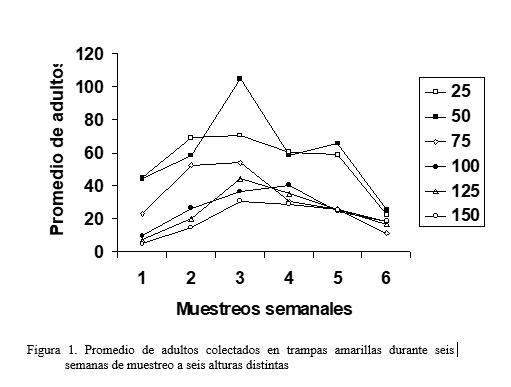
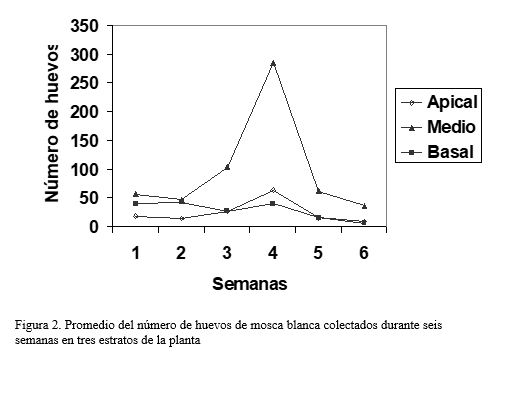
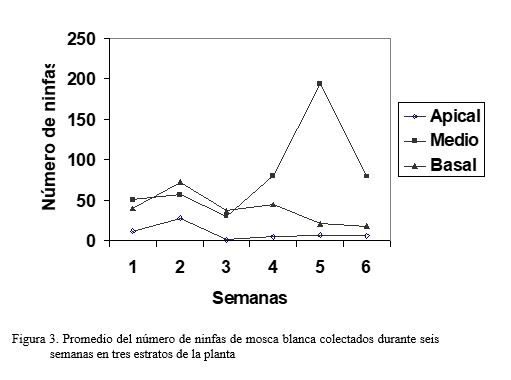
En relación al muestreo de huevos y ninfas, es necesario destacar que estas formas vivas se ubican en la cara abaxial de las hojas. Para determinar la incidencia de ninfas en varios genotipos de ajonjolí, Montilla et al. (1996), tomaron durante ocho semanas consecutivas tres hojas por planta (una del estrato apical, otra del medio y otra del basal) de siete plantas por cada parcela experimental, de cada hoja tomaron como área de muestreo 4 cm2. Laurentin y Pereira (2000a), también para estimar número de ninfas de mosca blanca sobre varios genotipos de ajonjolí, tomaron de cada parcela experimental durante seis semanas cinco hojas de cada uno de los tres estratos antes mencionados (apical, medio y basal), pero ante la observación de la falta de uniformidad de las ninfas sobre la cara abaxial de la hoja, realizaron los contajes sobre la totalidad de una de las mitades de la hoja. En este trabajo, los autores destacan la preferencia de B. tabaci de establecerse en el estrato medio de las plantas, por lo cual sugieren que las muestras para estimar las poblaciones de mosca blanca, utilizando huevos y/o ninfas deben ser tomadas en dicho estrato (figuras 2 y 3)
2.3. ¿Cuánto muestrear?
El tamaño de la muestra es un aspecto de gran importancia en la estimación de poblaciones de insectos, ya que esta va a determinar la eficiencia del muestreo. No existe ningún reporte en la literatura acerca del tamaño adecuado que deberían tener las muestras para estimar la población de mosca blanca en el ajonjolí, sin embargo, en el contaje de adultos, Pereira y Laurentin (1999) obtuvieron resultados adecuados, con bajos coeficientes de variación al realizar el contaje sobre los 36 cm2 centrales de las trampas amarillas, por tanto podría sugerirse la utilización de unas cinco trampas amarillas a una altura de 25-50 cms. por cada hectárea del cultivo, si lo que se desea es tener el estimado de adultos en una siembra comercial.
En relación a la toma de muestras cuando se cuantifican ninfas, Laurentin y Pereira (datos aún no publicados) demuestran que la utilización de tres hojas del estrato medio permite obtener la misma información que si se aumentara el tamaño de la muestra, esto en parcelas experimentales donde el objetivo que se perseguía era determinar la existencia o no de diferencias en número de ninfas de mosca blanca sobre varios genotipos de ajonjolí. Si la intención fuese evaluar en campos comerciales, se podría sugerir la utilización de cinco puntos en una hectárea, en cada uno de estos puntos se cuantificaría el número de ninfas de tres hojas tomadas del estrato medio.
2.4. ¿Cuándo muestrear?
Montilla et al. (1996) señala la existencia de una gran variabilidad en lo que a la abundancia del insecto se refiere durante el ciclo del cultivo, determinando un máximo en la población entre el 15 de febrero y el 2 de marzo. Laurentin y Pereira (datos aún no publicados) señalan que la máxima población de mosca blanca en el cultivo se presenta en las últimas semanas de febrero (en las figuras 1, 2 y 3, estas corresponden a las semanas 3, 4 y 5) y adicionalmente indican el efecto negativo que tienen las lluvias sobre el crecimiento de la población del insecto. En ambos trabajos, mediante muestreos semanales, se logró estudiar la fluctuación de la población del insecto.
El conocimiento de esta dinámica poblacional le ha permitido al productor manejar la fecha de siembra como estrategia de control muy efectiva, ya que al realizar la siembra en forma temprana (inicio de la temporada de sequía) asegura que será al momento de la cosecha, o después de esta, que se darán las grandes poblaciones de mosca blanca, por lo cual su cultivo evade al insecto, sin embargo esta práctica requiere de una preparación de tierras temprana, lo cual no siempre es posible, y además se corre el riesgo de perder totalmente el cultivo por efectos de encostramiento del suelo como consecuencia de las lluvias que para esa época son aún frecuentes.
- VARIABILIDAD DEL AJONJOLI EN RELACION A SU RESPUESTA ANTE LA MOSCA BLANCA
Montilla y Terán (1996) señalan una marcada variación en la incidencia de huevos y ninfas de mosca blanca sobre las plantas, al evaluar veinticuatro genotipos de ajonjolí en condiciones de infestación natural. Laurentin y Pereira (2000b), al evaluar seis genotipos durante dos años, también observan una amplia variación en la incidencia de huevos y ninfas de mosca blanca. En ambos resultados, se señalan las perspectivas favorables que pudiera tener un programa de mejoramiento genético de ajonjolí cuyo objetivo sea la obtención de algún cultivar con mecanismos de defensa contra la mosca blanca, debido justamente al amplio rango de variación en la incidencia del insecto sobre la planta.
En forma general, la resistencia de una planta a insectos plaga es clasificada como antixenosis, antibiosis y tolerancia (Nicks et al., 1993), definiéndose antixenosis como la no preferencia del insecto hacia algún(os) genotipo(s) en particular cuando este(os) es sembrado conjuntamente con otros, esta situación se da por la capacidad que tiene el insecto de seleccionar las plantas en las cuales cumplirá su ciclo de vida. Antibiosis es el efecto negativo que tiene la planta sobre el crecimiento de la población del insecto, fundamentalmente por composición química de la planta (producción de proteínas, presencia de algún metabolito secundario, acidez, etc.). Tolerancia es la capacidad de la planta de mantener una producción económicamente rentable aún en presencia de la plaga.
Los trabajos que hasta el momento se han realizado en los cuales se evidencia variabilidad en la respuesta de distintos genotipos ante el ataque de mosca blanca, no han sido diseñados para determinar si este rango de variación puede ser explicado por alguno de los tres mecanismos de defensa arriba mencionados. Sin embargo, Laurentin y Pereira (datos aún no publicados), al evaluar seis genotipos, señalan que la disminución del número de ninfas tomando como referencia el número de huevos de la semana anterior, como un hecho constante en dos genotipos, podría ser considerado como indicio de antibiosis. Laurentin et al. (2000) al determinar la presencia o ausencia de ocho metabolitos secundarios en las hojas de los mismos seis genotipos, logran construir un fenograma en el cual los dos genotipos con indicios de antibiosis forman grupos distintos del resto, lo cual refuerza la idea de que la naturaleza química de estos genotipos podría estar restringiendo el crecimiento de las poblaciones de mosca blanca. Laurentin et al. (datos aún no publicados) al determinar el pH de las hojas de seis genotipos de ajonjolí, observan que los de mayor acidez son los que presentan indicios de antibiosis, sugiriendo estos resultados que el pH podría ser una característica de gran importancia a ser considerada en los futuros programas de mejoramiento genético de ajonjolí orientados hacia la obtención de cultivares con mecanismos de defensa ante la mosca blanca.
CONCLUSIONES
- La mosca blanca se ha convertido en la mayor limitante biótica que presenta la producción de ajonjolí, debido a los daños directos que ocasiona el insecto a la planta cuando grandes cantidades de éste se alimentan de los fluidos nutritivos de la planta.
- Los muestreos de mosca blanca pueden realizarse sobre adultos o sobre estados inmaduros, al hacerlo con adultos se deben utilizar trampas amarillas ubicadas a 25-50 cms de altura, mientras que para estados inmaduros (huevos y ninfas) se debe realizar por observación directa de la cara abaxial de las hojas del estrato medio de la planta.
- Las máximas poblaciones de mosca blanca se consiguen la segunda mitad del mes de febrero y la primera semana del mes se marzo, lo cual permite manejar la fecha de siembra como una estrategia de control, al evitar la coincidencia de estas grandes poblaciones con las plantas de ajonjolí aún en campo. Igualmente se ha demostrado que las precipitaciones disminuyen grandemente las poblaciones de mosca blanca.
- Existe un amplio rango de variación en la respuesta de los distintos genotipos de ajonjolí evaluados en presencia de mosca blanca, identificándose posibles fuentes de antibiosis e incluso características químicas que permitan esta resistencia. Esta situación apunta hacia la existencia de muy buenas perspectivas en lo referente a la obtención de cultivares con mecanismos de defensa ante la mosca blanca.
REFERENCIAS BIBLIOGRAFICAS
ARNAL, E. 1991. Manejo integrado de moscas blancas. V Curso de Manejo Integrado de Plagas. FONAIAP, Lara. Vol. II. Noviembre 1991
ARNAL, E., F. RAMOS y E. DEBROT. 1993. Plantas hospederas de la mosca blanca Bemisia tabaci (Gennadius) en Venezuela. Agron Trop 43(5-6):226-235
BINNS, M. and J. NYROP. 1992. Sampling insect populations for the purpose of IPM decision making. Annu. Rev. Entomol. 37:427-453
BUTLER, G., D. RIMON and D. HENNEBERRY. 1988. Bemisia tabaci (HOMOPTERA:ALEYRODIDAE) populations of different cotton varieties and cotton stickness in Israel. Crop Protection 7:43-47
CRAMER, H. 1967. Plant protection and world crop production. Pflanzenschutz Nachrichten, Bayer 20
DELGADO, M. 1993. Evaluación del rendimiento y sus componentes en nueve cultivares de ajonjolí. Trabajo de Ascenso. Decanato de Agronomía. Universidad Centroccidental Lisandro Alvarado. Barquisimeto, Venezuela
DE PONTI, O., L. ROMANON and M. BERLINGER. 1990. Whitefly-plant relationships: plant resistance. In: Gerling, D. (ed.). Whiteflies: their bionomics, pest status and management. Intercept, Andover, Hants, UK
EKBOM, B. and X. RUMEI. 1990. Sampling and spatial pattern of whiteflies. In: Gerling, D. (ed.). Whiteflies: their bionomics, pest status and management. Intercept, Andover, Hants, UK
JAMES, C. 1981. The costs of disease to world agriculture. Seed Sci Technol 9:679-685
LAURENTIN, H. 1996. Evaluación del efecto de dos ciclos de selección recurrente sobre el rendimiento en una población de ajonjolí (Sesamum indicum L.). Tesis de Maestría. Facultad de Agronomía. Universidad Central de Venezuela. Maracay, Venezuela
LAURENTIN, H. & C. PEREIRA. 2000a. Spatial distribution of inmature stages of the sweetpotato whitefly (Bemisia tabaci) in sesame (Sesamum indicum). XXI International Congress of Entomology. Iguazu, Brazil. August 20-26
LAURENTIN, H. & C. PEREIRA. 2000b. Screening genotypes of sesame (Sesamum indicum L.) for resistance to whitefly (Bemisia tabaci Gennadius). Intenational Conference on Science and Technolohy for managing Plant Genetic Diversity in the 21st Century. Abstracts. Kuala Lumpur, Malaysia. June 12-16
LAURENTIN, H., C. PEREIRA, M. SANABRIA y E. CORDERO. 2000. Agrupamiento de genotipos de ajonjolí (Sesamum indicum L.) mediante la presencia de metabolitos secundarios y su relación con la incidencia de mosca blanca. XIV Congreso Venezolano de Botánica. Caracas, Venezuela. 18-21 de julio
LYNCH, R. and A. SIMMONS. 1993. Distribution of inmatures and monitoring of adults sweetpotato whitefly, Bemisia tabaci (Gennadius) (HOMOPTERA: ALEYRODIDAE), in peanut, Arachis hypogaea. Environ. Entomol. 22:375-380
MONTILLA, D. y H. TERAN. 1995. Evaluación de la incidencia de Bemisia sp. (HOMOPTERA:ALEYRODIDAE) en líneas de ajonjolí de diferentes ciclos. Informe Anual Consejo de Desarrollo Científico, Humanístico y Tecnológico de la Universidad Centrooccidental Lisandro Alvarado.
MONTILLA, D. y H. TERAN. 1996. Evaluación y selección de ajonjolí (Sesamum indicum L.) en generaciones avanzadas. Informe Anual Consejo de Desarrollo Científico, Humanístico y Tecnológico de la Universidad Centrooccidental Lisandro Alvarado
MONTILLA, D., E. LABRADOR y H. TERAN. 1996. Abundancia estacional de Bemisa sp. (HOMOPTERA:ALEYRODIDAE) y sus relación con once cultivares de ajonjolí y cuatro factores climáticos. Informe Anual Consejo de Desarrollo Científico, Humanístico y Tecnológico de la Universidad Centrooccidental Lisandro Alvarado
NARANJO, S. and H. FLINT. 1994. Spatial distribution of preimaginal Bemisia tabaci (HOMOPTERA:ALEYRODIDAE) in cotton and development of fixed precision sequential sampling plans. Environ. Entomol. 23:254-266
NARANJO, S., J. DIEHL and P. ELLSWORTH. 1997. Sampling whiteflies in cotton: validation and analysis of enumerative and binomial plans. Environ. Entomol. 26:777-788
NIKS, R., P. ELLIS and J. PARLEVLIET. 1993. Resistance to parasites. In: Hayward, M., N. Bosemark and I. Romagosa (eds.). Plant Breeding: principles and prospects. Chapman & Hall. London, UK
PEREIRA, C. Y H. LAURENTIN. 1999. Estimación de la altura de vuelo de los adultos de mosca blanca Bemisia sp. en el cultivo del ajonjolí. XVI Congreso Venezolano de Entomología. Santa Ana de Coro, Venezuela. 1-4 de julio
ROBINSON, R. 1987. Host management in crop pathosystems. MacMillan, New York. USA.
SIMMONS, A. 1994. Oviposition on vegetables by Bemisia tabaci (HOMOPTERA.ALEYRODIDAE): temporal and leaf surface factors. Environ Entomol 23(2):381-389
Ing. Agr. Hernán E. Laurentin T. (M. Sc., Ph. D.), Ing. Agr. Carlos Pereira (M. Sc., Ph. D.)





